Download Free Enzim Proteolitik Pdf
- Proteolytic Enzyme - Использование, побочные эффекты и отзывы. Соль Proteolytic Enzyme указана для лечения Нарушения воспаление, Воспалительные заболевания и других состояний. Подробная информация об использовании, побочных эффектах, взаимодействии, противопоказаниях и обзорах Proteolytic Enzyme представлена ниже: Proteolytic Enzyme Пользы. Proteolytic Enzyme используется для лечения, контроля, предотвращения и улучшения следующих заболеваний, состояний и симптомов: Нарушения воспаление. Воспалительные заболевания.
- Модификация муки тритикале с использованием. Протеолитических ферментных препаратов. Ключевые слова. Зерно тритикале; продукты протеолиза (пептиды, аминокислоты); протеолитические ферменты; ферментные препараты. Последние тенденции развития перерабатывающих отраслей.. Proteolytic enzymes; enzyme preparations. Recent trends in the development of processing branches of the food.
9 Пептидазы имеют существенное зна че - ние для выживания всех живых организмов и кодируются приблизительно 2% всех генов. Однако, несмотря на свои важные биологические функции, пептидазы могут обладать повреждающими свойствами для живых систем, поэтому должны находиться под строгим контролем. Существует не - сколь ко механизмов контроля чрезмерной активности пептидаз. Наиболее важным среди них является взаимодействие энзимов с протеинами, подавляющими их актив - ность.
Для таких веществ был введен термин «протеиновый ингибитор пептидазы». Существует большая вероятность того, что все протеины можно рассматривать с точки зрения наличия ингибирующего влияния на активность пептидаз in vitro и in vivo посред- ством образования комплексов с энзимами. В настоящее время пептидазы и их ингиби- торы — наиболее интенсивно изучаемые протеиновые комплексы. Структура инги- биторов, типы ингибирования, кинетичес - кие и термодинамические параметры этих процессов, природа энзимингибиторных комплексов весьма разнообразны. Изучение ингибиторов пептидаз нача- лось практически одновременно с открытием этих энзимов. В настоящее время известны сотни ингибиторов пептидаз протеиновой природы, и они являются объектами множе- ства исследований.
Эти исследования могут быть чрезвычайно перспективными для использования ингибиторов в медицине, REVIEWS УДК 577.112:579.22 ПРОТЕИНОВЫЕ ИНГИБИТОРЫ ПЕПТИДАЗ,ПРОТЕИНОВЫЕ ИНГИБИТОРЫ ПЕПТИДАЗ, СИНТЕЗИРУЕМЫЕ МИКРООРГАНИЗМАМИСИНТЕЗИРУЕМЫЕ МИКРООРГАНИЗМАМИ Ключевые слова: микроорганизмы, протеиновые ингибиторы пептидаз. ВАРБАНЕЦ Институт микробиологии и вирусологии им. Заболотного НАН Украины, Киев Еmail: Получено В обзоре систематизированы данные литературы о протеиновых ингибиторах пептидаз, синтези- руемых различными видами микроорганизмов. Показано, что в настоящее время на основании гомо- логии последовательностей аминокислот протеиновые ингибиторы сгруппированы в 77 семейств, 29 из которых содержат ингибиторы микроорганизмов. Механизм ингибирования пептидаз протеинами может быть связан либо с каталитическим механизмом действия пептидаз, либо включать не связан- ное с ним блокирование активного центра или его окружения.
May 15, 2018 - Download ПРОТЕИНОВЫЕ ИНГИБИТОРЫ ПЕПТИДАЗ. Михаэлиса, либо комплекса энзим−продукт, либо интермедиата ацил–энзим. Protease inhibitors in the treat- ment of hereditary angioedema // Transfus. Some free–living bacteria are able to synthesize protein inhibitors to.
Структурные элементы протеиновых ингибиторов, ответственные за связывание с пептидазами, в большинстве своем включают N- или C- концевые последовательности, незащищенные полипептидные петли (цепи), действующие независимо или в комбинации с другими элементами. Проанализированы основные свойства, структурные особен- ности и, где это установлено, функции протеиновых ингибиторов пептидаз. Поскольку некоторые про- теины эффективно ингибируют такие пептидазы, как субтилизин, химотрипсин, панкреатическую эластазу, возможно их практическое применение для лечения таких заболеваний, как эмфизема лег- ких, артрит, панкреатит, тромбоз, повышение артериального давления, мышечная дистрофия, рак.
Предполагают, что роль бактериального гомолога альфа-макроглобулина Escherichia coli, являющегося периплазматическим протеином, заключается в защите периплазматического пространства от дейст вия собственных пептидаз бактерии. Благодаря специфическому свойству альфа-2-макроглобулинов свя- зывать активные молекулы эндопептидаз они нашли применение в биотехнологии для выделения эндо- пептидаз из неочищенных биологических препаратов и для титрования их активных центров. У некоторых свободноживущих бактерий протеиновые ингибиторы могут синтезироваться для защи- ты от действия собственных энзимов, в то время как для патогенов наличие этих протеинов может играть определенную роль как в инфекционном процессе, так и в системе защиты от пептидаз хозяина. BIOTECHNOLOGIA ACTA, V. 6, No 6, 2013 10 сельском хозяйстве и биотехнологии.
По ни - ма ние характера взаимодействия протеи но - во го ингибитора с энзимами является пред- посылкой для разработки новых подходов к синтезу синтетических ингибиторов, кото - рые могут впоследствии применяться как лекарственные средства. Многие ингибито- ры естественного происхождения, такие, например, как антикоагулянт «гирудин», используют в качестве основы препаратов протеинов для инъекций 1. Существует ряд наследственных заболеваний, которые связаны с нарушениями во взаимодействии пептидаза−ингибитор.
К ним относятся раз- личные формы эмфиземы легких, эпилеп- сия, наследственный отек Квинке и синдром Нетертона 2−5. Их патологический про- цесс можно корректировать введением син- тетических или природных ингибиторов пептидаз. Причиной ряда болезней может стать также чрезмерная активность протео- литических энзимов, последствия которой может устранить генная терапия 6, 7. Для удовлетворения потребностей сельского хозяйства изучают генетически модифици- рованные культуры растений, в которых экс- прессируются ингибиторы гидролитических энзимов их насекомых-вредителей 8, 9.
Первый обзор по протеиновым инги би - торам пептидаз был опубликован в начале 80-х гг. Авторы отметили, что ранее ингибиторы называли по активности к известным энзимам (чаще всего трипсину, химотрипсину и субтилизину): например, «ингибитор субтилизина из Streptomyces» или «ингибитор трипсина из под желу доч - ной железы». Такие названия не давали воз- можности понять связь между ингиби - торами и оценить, насколько информацию о механизме действия одного ингибитора можно применить к другим. Было очевидно, что пептидазные ингибиторы необходимо классифицировать по гомологичным семей- ствам, но в то время достоверная информа- ция, касающаяся их аминокислотной после- довательности, существовала лишь для ограниченного количества протеинов, поэтому официально признанными были лишь около десятка семейств. Главным пре- пятствием классификации ингибиторов пептидаз по гомологии их аминокислотной последовательности является тот факт, что многие из этих протеинов содержат повто- ряющиеся ингибиторные домены на един- ственной полипептидной цепи.
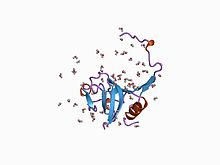
Эти области не идентичны друг другу, но обладают функ- цией ингибирования. Отличающееся число повторов позволяет объединять ингибиторы на основании их аминокислотной последова- тельности.
Начиная с конца ХХ — начала ХХІ вв. Была сделана новая попытка классифициро- вать и дать названия ингибиторам протеоли- тической активности протеиновой природы 11. Веб-сайт MEROPS (ger.ac.uk/inhibitors/) наряду с классифика- цией пептидаз и их субстратов включает информацию относительно ингибиторов пептидаз. Классификация протеиновых ингибиторов постоянно дополняется, и в на - стоящий момент на основании гомологии последовательностей аминокислот они сгруп - пированы в 77 семейств, объединенных в 51 клан исходя из сходства их третичной структуры.
Механизм ингибирования пеп- тидаз протеинами может быть связан с ката- литическим механизмом действия энзима либо включать не связанное с ним блокиро- вание активного центра или его окружения. Структурные элементы протеиновых инги- биторов, ответственные за связывание с пеп- тидазами, в большинстве своем содержат N- или C-концевые последовательности, неза- щищенные полипептидные петли (цепи), действующие независимо или в комбинации с другими элементами. Отличающиеся по способу укладки протеиновые структуры ответственны за различные несвязанные типы ингибирования 12. Например, β- складчатая структура вовлекается в ингиби- рование цистеиновых, сериновых и метал- лопептидаз 13. Механизмы ингибирования охватывают: 1) образование комплекса Михаэлиса, либо комплекса энзим−продукт, либо интермедиата ацил–энзим; 2) непро- дуктивное связывание; 3) стерическое бло- кирование активного центра. По первому механизму действуют практически все тра- диционные протеиновые ингибиторы сери- новых пептидаз типа бычьего панкреатиче- ского ингибитора трипсина или овомукоида, а также серпины, гирудин и многие другие.
По этому механизму функционируют и некоторые ингибиторы цистеиновых (циста- тины, стафостатины, тиропины), аспартиль- ных (сахаропепсин) и металлопептидаз (ингибиторы из Streptomyces nigrescens, Erwinia chrysanthemi, Pseudomonas aerugi- nosa). Механизм ингибирования путем непродуктивного связывания характерен для ингибиторов апоптоза (IAPs), действую- щих на специфические каспазы 14. В неко- торых случаях полипептидная цепь ингиби- тора способна блокировать активный центр пептидазы таким образом, что контакт с каталитическим центром пептидазы не Reviews 11 устанавливается, а наблюдается стериче- ское блокирование активного центра.
Классический пример такого взаимодейст - вия — ингибирование цистатинами папаин - подобных цистеиновых пептидаз 15. Регуляция протеолиза является общим свойством многоклеточных организмов и, в основном, отсутствует у прокариот и одно- клеточных эукариот.
Регулирование про- теолиза у прокариот происходит на несколь- ких уровнях, в том числе транскрипции генов и синтеза протеина. Системы регули- рования включают в себя синтез пептидаз в виде зимогенов (проэнзимов), которые акти- вируются после достижения заданного места локализации, — в случае прокариот это периплазма или внеклеточная среда. Иногда протеолитическая активность регу- лируется также ингибиторами пептидаз. Однако некоторые бактерии и археи приобре- ли гены, кодирующие различные виды ингибиторов пептидаз 16 (табл. Ингибиторы семейства I1 Протеины семейства I1, часто называе- мые «семейство ингибиторов Kazal», инги- бируют активность сериновых пептидаз как семейства химотрипсина (S1), так и субти- лизина (S8).
Они широко распространены среди растений и животных, в том числе бес- позвоночных, а также бактерий, но редко встречаются у простейших, отсутствуют у грибов и вирусов. Гены, кодирующие гомо- логи ингибиторов семейства I1, были найде- ны у 11 видов бактерий типа Proteobacteria. Представители этого семейства ингиби- руют пептидазы по «стандартному» меха- низму Laskowski-младшего 10. Согласно этому механизму ингибитор взаимодейству- ет с пептидазой по типу энзим−субстрат. Ингибиторы, подчиняющиеся этому меха- низму, высокоспецифичны и ограничивают протеолиз субстратов пептидазами. На поверхности каждой молекулы ингибитора находится по крайней мере одна (или боль- ше — в мультидоменных ингибиторах) пеп- тидная связь, называемая реактивным цент- ром, которая взаимодействует с активным центром энзима.
Значения kcat/Km для гид- ролиза этой связи пептидазой при нейтраль- ных значениях рН очень высоки и состав- ляют 104−106 M–1с–1, в то время как для субстрата — 103 М–1с–1. Для ингибиторов значения как kcat, так и Km на несколько порядков ниже, чем для субстратов.

Поэтому при обычно используемых кон- центрациях и нейтральном рН их гидролиз происходит крайне медленно, при этом система ведет себя так, как если бы это было простое равновесие между энзимом и свобод- ным ингибитором, с одной стороны, и их комплексом — с другой. Константа равнове- сия ассоциации этих комплексов чрезвы- чайно высока и находится в диапазоне от 107−1013 M–1.
Дополнительным свойством ингибиторов является то, что полный гидро- лиз их реактивного центра не происходит. При нейтральных значениях рН константа равновесия между модифицированным (пептидная связь реактивного центра гидро- лизована) и интактным (пептидная связь реактивного центра остается нетронутой) ингибиторами близка к единице. Стабиль - ные комплексы образуются также между энзимом и свободным (или модифицирован- ным) ингибитором, которые являются тер- модинамически одинаково активными ингибиторами для энзима. Ингибиторы семейства I2 Принадлежащие к этому семейству ингибиторы играют важную роль в регули- ровании активности сериновых пептидаз у животных. Гомологи этих энзимов были найдены у растений, простейших, вирусов. Известным представителем семейства является апротинин. Его используют для лечения таких заболеваний, как острый панкреатит и нарушение процесса свертыва- ния крови 17.
У бактерий гены, кодирую- щие гомологичные протеины, выявлены только у представителей 10 видов, относя- щихся к трем различным типам бактерий: Bacteroidetes, Cyanobacteria и Proteobac te - ria, при этом ничего не известно об их функ- циях. Механизм ингибирования такой же, как и для семейства І1 10. Ингибиторы семейства I4 В состав семейства I4 входят ингибиторы сериновых (S1, S8) и цистеиновых пептидаз (C1, C14). Существование в плазме крови людей ингибитора трипсина было установлено в 50-х гг. ХХ в., а в течение 60-х гг. С помо- щью электрофоретических и иммунологиче- ских методов из плазмы были выделены несколько различных протеинов, ингиби- рующих трипсин; наиболее распространенный из них был назван «альфа-1-антитрипсин». Стало очевидно, что у человека встречаются различные формы ингибитора, в том числе и функционально недостаточные.
Люди, у которых присутствуют такие формы ингиби тора, имеют наследственные заболе- вания. Установлено также, что ингибитор BIOTECHNOLOGIA ACTA, V. 6, No 6, 2013 12 Т а бл и ц а 1.
Автор: Neil D. Rawlings Название: Handbook of Proteolytic Enzymes, 3d edition Издательство: Academic Press Год: 2013 Формат: PDF Размер: 70.4 Mb Язык: Английский The third edition of the Handbook of Proteolytic Enzymes is a comprehensive reference work for the enzymes that cleave proteins and peptides, written by acknowledged experts in the field and containing over 850 chapters. Each chapter is organized into sections describing the name and history, activity and specificity, structural chemistry, preparation, biological aspects, and distinguishing features for a specific peptidase. There are also introductory chapters on peptidase classification and mechanisms and a comprehensive index. For the first time, the Handbook is also available online via Elsevier's ScienceDirect platform as well as a three-volume book. The online version has enhanced options, including online multimedia, cross-referencing capabilities, integrated online delivery and closer integration with the online MEROPS database of peptidases and their inhibitors. This reference work is a must-have for biochemists, biotechnologists, molecular biologists and students in these disciplines, and will be of great interest to pharmaceutical and biotechnology companies.
Contains over 830 chapters - Covers new research in therapeutics and drug trials - Supplies content written by experts in the field depositfiles rapidgator bitshare Рейтинг: 4.8 баллов / 2537 оценок Формат: Книга Уже скачали: 12658 раз.